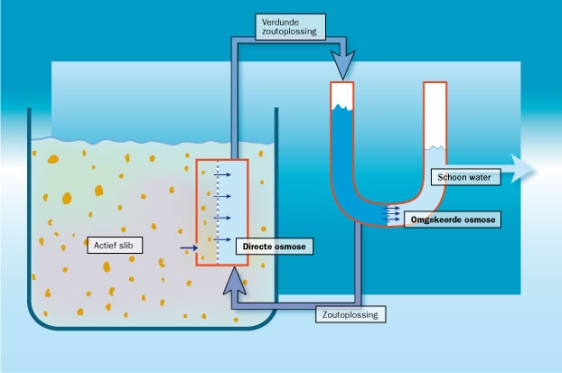
Een membraan kan water selectief doorlaten terwijl ionen (zouten) tegengehouden worden. Dit is een proces dat onder andere gebruikt wordt voor het ontzouten van water, bijvoorbeeld voor de watervoorziening op oceaanschepen.
Het proces waarbij zout water door een semi-permeabel membraan wordt geperst om zodoende water te ontzouten heet omgekeerde osmose. De druk die je hiervoor nodig hebt, bedraagt ongeveer 21 bar. Dit is het gevolg van de zogenaamde osmotische druk van een oplossing. Twee vloeistoffen gescheiden door een semi-permeabel membraan streven naar een gelijke concentratie aan beide zijden. Het zeewater bevat veel meer zout en dus zal er water van de ontzoute kant naar de zoutwaterkant gaan aangezien de zouten zelf niet door het membraan kunnen. De theorie die dit verschijnsel beschrijft is door Jacobus van ‘t Hoff ontwikkeld. Hij liet zien dat de osmotische druk evenredig is met concentratie. De Nederlander van ‘t Hoff kreeg hiervoor in 1901 de Nobelprijs voor de scheikunde.
Bron: Dr. ir. Rob Lammertink, Membrane Technology Group, Universiteit Twente.

